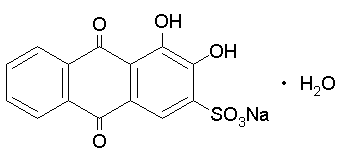
Color Index Name=Alizarin Red S
| Rome University, La Sapienza Chemistry Department Rome, Italy, Europe |
Dr. Giovanni Visco Programmi, orari, esercitazioni |
Corso di Laurea in Scienze Applicate ai Beni Culturali ed alla Diagnostica per la loro Conservazione |
| previous, index | eserc.2, next |
Questa pagina non vuole e non puo' sostituire la lezione ed assolutamente non puo' sostituire il laboratorio ma e' stata scritta per aiutare gli studenti ad inquadrare meglio l'esercitazione teorico/pratica.
i colorantiIl mondo e' a colori, il mondo dell'arte era a colori gia' per gli uomini preistorici, per le prime civilta' cinesi o nate fra i Tigri e l'Eufrate come ci ricorda una bella mostra al Vaticano (I colori del bianco .JPG 413 KBytes), argomento della post-ultima lezione.
Quest'anno utilizziamo un colorante gia' noto agli egizi, anzi ai babilonesi (hanno anche inventato la citta-stato ma la democrazia la portiamo noi!), il Rosso di Robbia, rubia tinctorum, che oggi sappiamo costituito principalmente da Alizarin Red. Questo colorante con un trattamento che ora e' finito nell'oblio puo' diventare anche un pigmento, uno dei due pigmenti organici.
obiettivo dell'esercitazionePrimo obiettivo e' determinare la concentrazione (in % p/p) di Alizarin Red in una soluzione di vero rosso di robbia. Soluzione preparata sciogliendo radice macinata in acqua distillata. Secondo obiettivo e' determinare la concentrazione di Alizarina in una soluzione incognita (ma preparata da uno dei dottorandi di chimica) per saggiare l'abilita' diagnostica degli studenti. Per aumentare la difficolta' il colorante non e' puro ma in miscela per formare una specie di violetto.
Utilizzare un colorante ha vari scopi, fra i tanti la necessita' di usare basse concentrazioni che rendono piu' difficile la pesata, ottenere spettri di assorbimento noti e riproducibili, ottenere soluzioni che possono essere utilizzate per settimane. Pero' al termine della prima esercitazione l'aspetto piu' interessante sono le macchie rosse sparse per il laboratorio, sul bancone, sulla bilancia che mostrano (agli studenti) come sia difficile muoversi in laboratorio, non perdersi polveri e/o soluzioni, ottenere concentrazioni con un qualche grado di accuratezza.
Come detto in precedenza nel Rosso di Robbia (rubia tinctorum, cultivar: madder family) c'e' l'Alizarin Red che produce un colore molto intenso in una soluzione gia' con soli 50 milligrammi in un litro. Quella che segue e' la formula di struttura e alcuni riferimenti utili a chi volesse saperne di piu' in merito al 3,4-Dihydroxy-9,10-dioxo-2-anthracenesulfonic.
 |
| CAS number=130-22-3, Color Index=58005, Color Index Name=Alizarin Red S |
Ancor prima di cominciare bisogna decidere con cosa preparare le varie soluzioni per questa e per la prossima esercitazione. Utilizziamo non la normale acqua distillata disponibile per il Dipartimento ma la sottoponiamo ad un'ulteriore processo di purificazione.
 |
| lo strumento misura la conducibilita' dopo il passaggio attraverso le resine |
Come sapete la conducibilita' misura la quantita' di ioni presenti nella soluzione, non misura la presenza di specie non cariche come gas, sostanze organiche, ma per questo noi utilizziamo in ingresso alle resine acqua distillata (cioe' ebollizione e ricondesazione) di Dipartimento.
La vetreria di laboratorio e' appunto "di laboratorio" cioe' utilizzata per tante analisi. Prima di poterla utilizzare necessita di una accurata pulizia e nel frattempo un controllo della integrita' strutturale.
Tutta la vetreria utilizzata e' stata sottoposta ad un accurato lavaggio tipico di un buon laboratorio (senza lavatrice). Per la pulizia e' stato utilizzato il solito metodo del "misto solfo-cromico" del 1947, come mostrato dalle foto seguenti, ma dopo aver letto la scheda di sicurezza. In presenza di vetreria con tracce importanti di sostanze organiche un secondo passaggio e' consigliato con la famosa potassa-alcolica di S.T. McCallum, del 1921, o la piu' moderna alcoholic potassium hydroxide cleaning solution. Per i lavaggi usiamo acqua distillata di Dipartimento prelevata di fresco.
 |
| il misto cromico, pulito a sinistra ed esausto a destra |
Nella foto, a sinistra il Misto Solfo-Cromico fresco e che ha bagnato bene tutte le pareti del matraccio. Pero' potete notare come all'interno si vede una zona non coperta che necessita' di ulteriore lavaggio. A destra invece il tipico colore del Misto esausto.
Dopo aver versato con attenzione il Misto dal matraccio al suo contenitore si lava la vetreria con una piccola quantita' di acqua dolce (o meglio distillata) e si scarica questa soluzione negli acidi diluiti di scarto. Si fanno ora tre-quattro lavaggi con volumi pari la 10% del matraccio con acqua distillata e si controlla il pH ottenuto.
 |
 |
| 1) a sinistra l'acqua di lavaggio, NON va | 2) a destra l'ultimo lavaggio, e' acido |
Si versa in un becker l'acqua distillata usata per il lavaggio e nell'altro l'acqua in uscita dal matraccio. Utilizziamo una cartina di pH per controllare che non ci siano differenze. Nella foto 1) a sinistra l'acqua distillata ed a destra l'acqua di lavaggio sono ancora presenti tracce dell'acido solforico (vedi Miscela Solfo-Cromica) usato per la pulizia, nella foto 2) una vista ravvicinata delle cartine con 4 indicatori piu' accurate di quelle a rotolo, quella di destra indica un pH di circa 4. In questi casi si fanno sempre altri due lavaggi ulteriori con acqua distillata.
Dovendo maneggiare miscele molto aggressive (che devono esserlo per ripulire la vetreria) bisogna leggere con attenzione le schede di sicurezza e usare tutti i mezzi di protezione necessari. Meglio soffrire il caldo per 1/2 ora dentro una tuta antiacido, con le scarpe adatte e con casco e maschera piuttosto che farsi male per superficialita'. Intanto che ci siamo ricordiamo che i mezzi di protezione ..... proteggono noi ma sono indispensabili per proteggere il campione e i contenitori durante un prelievo.
Dicevamo che con questa esercitazione cerchiamo di misurare la concentrazione incognita di un colorante utilizzato da millenni per la tintura di stoffe e qualche volta anche come pigmento.
 |
| qui sopra il colorante industriale, poi la lacca, la farina prodotta dalla radice secca, ed infine la radice secca sminuzzata |
Non e' facile trovare oggi dei coloranti e dei pigmenti prodotti artigianalmente, per la fornitura del rosso di robbia che vedete nella foto qui sopra dobbiamo ringraziare il Museo dei Colori Naturali di Lamoli presso L'Oasi San Benedetto si trova a Lamoli frazione del Comune di Borgo Pace sulla statale 73 bis (Bocca Trabaria). Questa citazione e' il minimo che posso fare per ringraziarli.
Sempre dall'Oasi San Benedetto e' in arrivo anche il giallo reseda che useremo in una prossima esercitazione, grazie. A proposito ho scoperto che vicino c'e' anche un agriturismo, bisognera' farci una visita.
Per utilizzare il metodo dei minimi quadrati (O.L.S.) abbiamo deciso di preparare concentrazioni con errore minore di 1‰ e per trovare la zona di linearita' prepariamo una serie di soluzioni, alcune di certo inferiori al L.O.D. del metodo altre di certo superiori alla saturazione e tante in mezzo.
L'esperienza ci suggerisce di preparare le seguenti: 200 mg/L, 100 mg/L, 80 mg/L, 50 mg/L, 40 mg/L, 20 mg/L, 10 mg/L, 8 mg/L, 5 mg/L, 4 mg/L, 2 mg/L, 1 mg/L, 0.8 mg/L, 0.5 mg/L, 0.4 mg/L, 0.2 mg/L, 0.1 mg/L, 0.08 mg/L, 0.05 mg/L, 0.04 mg/L.
 |
| la serie di soluzioni di colorante preparate di fresco |
Dall'anno scorso abbiamo a disposizione anche un matraccio da 10.000 mL (cioe' 10 Litri) con cui possiamo preparare una soluzione da 1 mg/L mantenendo l'errore finale sotto 1‰. Le altre soluzioni devono essere preparate per singola diluizione con il miglior strumento disponibile per il prelievo di un volume. Per minimizzare la possibilita' di errori bisogna randomizzare la scelta della soluzione di partenza. Qui allegato c'e' un file con una tabella delle soluzioni da preparare (esercitaz-robbia.xls, 15 KBytes).
Ove si notino delle differenze con i dati dell'anno precedente ricordiamo che tutto lo strumento e' stato sottoposto da qualche mese a calibrazione e certificazione per soli 2000 euro. Notate percio' quanto sia necessario l'intervento periodico della casa costruttrice.
Forse qui e' il caso di ricordare che fa parte dell'insegnamento anche tutta la parte legata alla regressione e correlazione (che potete trovare in queste slide) in cui si presentano anche la bilancia analitica (Gibertini E50S), lo spettrofotometro, il metodo dei minimi quadrati, la preparazione di soluzioni a titolo noto con l'aiuto del famoso file error_on_solutions.123.
 |
| bilancia analitica, risoluzione 0.00001 grammi (10 µg) |
Ancor prima di preparare le soluzioni bisognerebbe controllare che tutto il nostro metodo per la preparazione delle concentrazioni a titolo noto produca risultati riproducibili. Si decide di preparare una concentrazione di 40 mg/L con tre pesate consecutive, utilizzando tre matracci da 500 ml di marche diverse, con tre operatori che pesano, cercando un accuratezza migliore del 1‰. Potremmo definire questa come riproducibilita' del laboratorio, che viene rispettata anche se cambiano le persone, gli strumenti, ecc..
Di queste tre soluzioni una e' anche i 40 mg/L della curva di calibrazione, a lezione spieghiamo come sceglierla (e magari lo chiediamo all'esame :-) ). Qui potete trovare un file gia' pronto per raccogliere le misure con lo spettrofotometro, le conc. reali, valore ed assorbanza di tutti i possibili picchi (esercitaz-robbia-measured.xls, 17 KBytes).
 |
| 3 soluzioni per il test della riproducibilita', 3 matracci, 3 pesate |
Questo e' lo spettro del colorante (AlizaRed10.png, 4 KBytes, usate Back per tornare qui), ignoto, utilizzato e questi sono i risultati ottenuti per le tre concentrazioni e per i quattro picchi prodotti dalla spettrofotometria di assorbimento nel campo UV-Vis (per i parametri operativi vedi piu' avanti). Guardandolo bene si nota il picco nel visibile, un picco nel vicino UV, uno a 259 nm con altri due sulle sue spalle ed uno (mal individuato dal software) a quasi 200 nm.
| Conc, g/L | nm | Abs | a | nm | Abs | a | nm | Abs | a | nm | Abs | a | nm | Abs | a |
| 0.03996 | 199.7 | 1.819 | 45.53 | 258.8 | 2.604 | 65.16 | 333.0 | 0.344 | 8.61 | 422.8 | 0.437 | 10.92 | |||
| 0.04078 | 198.8 | 2.011 | 49.32 | 258.1 | 2.837 | 69.57 | 332.8 | 0.380 | 9.31 | 423.4 | 0.484 | 11.87 | |||
| 0.04026 | 192.9 | 1.979 | 49.16 | 259.1 | 2.783 | 69.13 | 332.8 | 0.367 | 9.11 | 422.8 | 0.477 | 11.84 | |||
| average | 197.1 | 48.00 | 258.7 | 67.95 | 332.9 | 9.01 | 423.0 | 11.55 | |||||||
| std. dev. % | 1.52 | 3.65 | 0.17 | 2.92 | 0.03 | 3.28 | 0.07 | 3.81 |
Usiamo tutti e 4 i picchi individuabili e riportiamo in tabella la concentrazione ottenuta per pesata diretta in g/L, i nanometri del picco di assorbanza (nm), il relativo valore di assorbanza (Abs), l'assorbanza specifica per un grammo litro (a). Particolare attenzione va posta allo scarto quadratico medio percentuale che usiamo per analizzare questa parte di esercitazione.
In grassetto il valore ottenuto per la riproducibilita' dei nm: come gia' detto lo strumento e' stato appena calibrato, si vede con la riproducibilita' dei nm (1.52, 0.17, 0.03, 0.07, il peggiore e' appunto al limite dello strumento con un picco che anche il software fatica ad individuare). I valori in rosso sono quelli che ci interessano, dovuti alle operazioni svolte dagli studenti.
Questo e' il peggior risultato ottenibile. Due soluzioni in accordo, una distante. Come scusante si pottrebbe dire che era la prima volta che preparavano questa soluzione e che gli veniva richiesto una accuratezza minore dell'uno per mille. Era anche la prima volta che svolgevano una simile procedura (ricordate le tante slide precedenti, conoscere attentamente progetto, metodo, strumento e fare cento prove prima di fare la misura sull'unico campione disponibile). Comunque non si poteva fare peggio, almeno se fossero tutte diverse potremmo cercare cosa e' successo.
Per cercare di arginare il danno si sceglie uno solo degli studenti che da ora svolgera' il compito di "pesare", gli altri lavoreranno alla dissoluzione del colorante, per portare a volume, diluire, ecc..
Ci stavamo per dimenticare una cosa che si puo' chiedere all'esame, quali parametri avete usato per lo spettrofotometro? Nei tre screen-capture qui sotto le risposte.
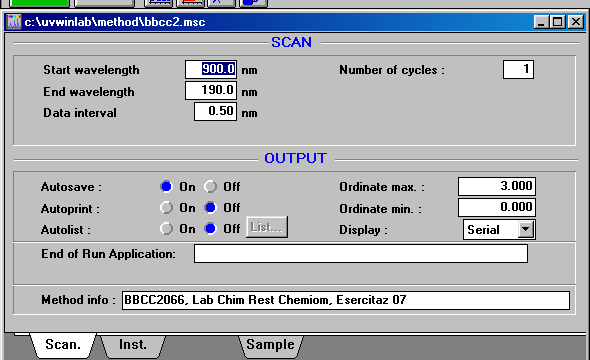 |
| scelto un metodo, poi i setting dei parametri di scansione, speed, Abs max, min-max, ecc. |
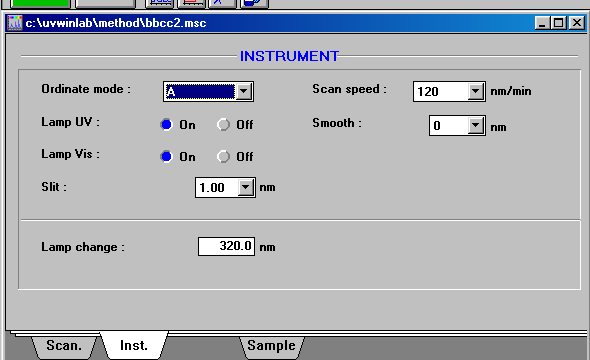 |
| cambio lampada, velocita', trasmittanza, ed altri setting |
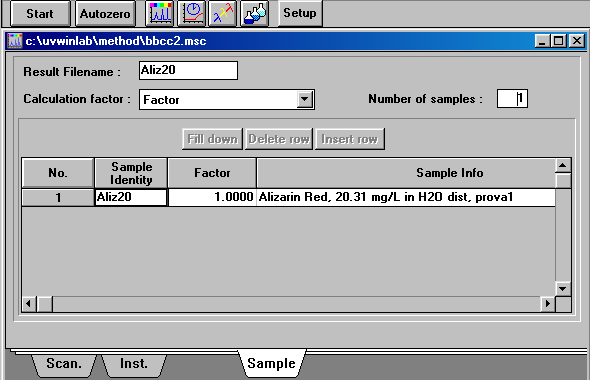 |
| filename, factors, ecc. e finalmente the blank correction |
Dato il risultato precedente ci tocchera' applicare ai risulati un errore su "a" di almeno il 3%, purtroppo. Ove ci fosse tempo io consiglierei di ricominciare da capo, con gli stessi gruppi, pero' questa volta scrivendo chi prepara cosa.
Solo per rendere un poco piu' difficile le misure cominciamo con la concentrazione da 200 mg/L e via via misuriamo le altre scendendo. Bisogna porre grande cura nel lavare ed avvinare la cuvetta da 10 mm utilizzata visto che la soluzione seguente e piu' diluita.
Si inizia impostando una assorbanza assurda per lo strumento (esempio = 4) e azzerando con la stessa acqua distillata usata per la dissoluzione.
Quando lo spettro e' diventato ormai troppo basso e' buona norma ripetere "l'autozero" cambiando la Abs max con un valore adeguato alla prossima soluzione in esame. Con i valori, discendenti, cosi' rilevati si potra' costruire una retta di calibrazione, per questo colorante, per questa matrice, per questo spettrofotometro, con queste cuvette e con questa acqua di dissoluzione.
| conc. mg/L | low λ peak-Abs | midl λ peak-Abs | high λ peak-Abs |
| 201.6 | 422.5-2.3468 | ||
| 110.3 | 422.5-1.3073 | ||
| 81.1 | 422.5-0.9710 | ||
| look! 51.28 | 200.6-2.5581 | 258.8-3.3779 | 422.7-0.6304 |
| 40.26 | 199.9-1.9677 | 259.1-2.7831 | 422.5-0.4768 |
| 20.01 | 199.9-0.9951 | 259.1-1.4344 | 422.5-0.2350 |
| 10.005 | 199.9-0.4930 | 259.1-0.7258 | 422.5-0.1187 |
| 7.95 | 199.9-0.4044 | 259.1-0.5964 | 422.5-0.0962 |
| 5.008 | 199.9-0.2577 | 259.1-0.3749 | 422.5-0.0603 |
| 4.092 | 199.9-0.2034 | 259.1-0.3090 | 422.5-0.0452 |
| 1.988 | 199.9-0.1073 | 259.1-0.1479 | 422.5-0.0222 |
| 1.011 | 199.9-0.0357 | 259.1-0.0697 | 422.5-0.0113 |
| 0.795 | 199.9-0.0292 | 259.1-0.0572 | 422.5-0.0075 |
| 0.5008 | 199.9-0.0161 | 259.1-0.0350 | 422.5-0.0042 |
| look! 0.4092 | 201.4-0.0137 | 260.8-0.0285 | 420.2-0.0017 |
| 0.1988 | 199.9-0.0034 | 259.1-0.0106 | |
| 0.101 | 259.1-0.0039 | ||
| 0.0795 | noise | noise | noise |
Non criticate subito! Non e' che abbiamo pesato 5.008 mg, la bilancia si e' fermata a 0.02504 g e questi sono stati sciolti in 5 litri. Riguardate il file con le pesate da effettuare. Partendo dal famoso file Lotus, ecco un file con raccolti i vari valori misurati.
Gli studenti che hanno potuto utilizzare il software di gestione dello spettrofotometro se lo ricorderanno per anni e ci ringrazieranno visto che lo stesso e' utilizzato anche da alcuni HPLC e Gas Cromatrografi. Per esempio si puo' partire dalla curva a sinistra ed ottenere quella a destra con qualche click del mouse (e tanta teoria!).
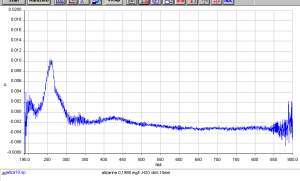 |
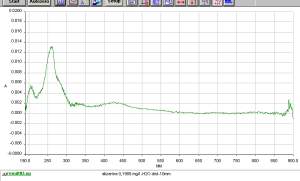 |
| lo spettro originale con Abs shift e rumore | dopo la correzione dell'Abs e smoothing |
Ora per prima cosa ci chiediamo: i picchi che abbiamo scelto per costruire la curva di calibrazione cambiano con la concentrazione del colorante? Cioe' si evidenzia un effetto come quello di un acido/base debole via via che si diluisce?. Ma anche nella esercitazione dell'anno precedente abbiamo voluto fare questo controllo, ora si puo' continuare a leggere l'esercitazione dell'anno precedente.
Al termine bisogna evidenziare un errore di tutto il progetto, che di certo un lettore attento avra' gia' individuato, il colorante industriale qui utilizzato e' solfonato, e stiamo usando il sale sodico, questo perche' e' molto piu' solubile della versione senza il gruppo SO3Na presenta nella radice. Questo porta a diversita' negli spettri e ad errori nel calcolo della concentrazione, si ma stimabili in qualche %
| Universita' Degli Studi di Roma La Sapienza |
Dr. G. Visco appointed professor for chemometrics & .... |
Dipartimento di Chimica |
| previous, index | eserc.2, next |